Quelles interactions assurent la cohésion de la matière à l'état solide ?
Dans les solides ioniques
Pour expliquer la cohésion des solides ioniques, nous pouvons réaliser une expérience toute simple : il nous faut deux tiges de verre et un morceau de laine et nous allons les frotter chacun leur tour sur le morceau de laine. Ensuite on rapproche les deux tiges de verre et on observe.
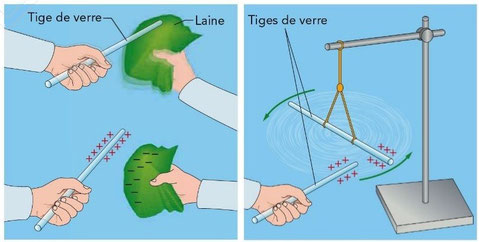
Lors du frottement, les électrons sont transférés de la tige de verre vers la laine. La tige de verre porte alors une charge positive. Lorsque que l'on rapproche les deux tiges de verre qui sont chargées de même signe, elles se repoussent.
Donc on peut conclure que des corps portant des charges de même signe se repoussent, alors que des corps portant des charges de signes contraires s'attirent.
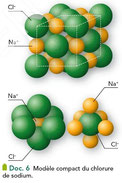
Un solide ionique (ou cristal ionique) est constitué d'anions et de cations, assimilés à des sphères dures, régulièrement disposées dans l'espace. Un solide ionique est électriquement neutre.
Dans un cristal ionique, chaque ion s'entoure d'ions de signes opposés. L'interaction électrostatique existant entre ces ions de charges contraires assurent la cohésion du solide ionique. Les ions occupent des positions déterminées et sont immobiles.
Nous pouvons appliquer ce principe aux colles : certaines colles créent des liaisons chimiques de type ionique : au contact de la colle, un atome du matériau à coller donne un électron à un atome de la colle ; devenus de charges opposées, les atomes s'attirent assurant le collage. C'est le cas par exemple de la colle blanche qui pour faire tenir deux feuilles de papier entre elles, utilise ce type de liaison.
Il est possible de calculer cette force d'attraction, grâce à la loi de Coulomb qui nous dit que :
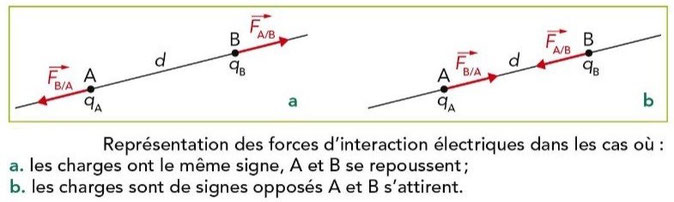
Deux corps ponctuels A et B, séparés d'une distance d et portant les charges électriques qA et qB exercent l'un sur l'autre des forces FB/A et FA/B telles que :
FB/A = - FA/B
Ces deux forces :
-
ont la même direction : celle de la droite (AB) ;
-
sont respectivement appliquées en A et en B ;
-
sont répulsives si les charges sont de même signe et attractives si les charges ont des signes opposés ;
-
ont la même valeur F, telle que :

Avec k = 9,0 x 10^9 N∙m²∙C^-2, F en newton (N), qA et qB en coulomb (C) et d en m.
Dans les solides moléculaires
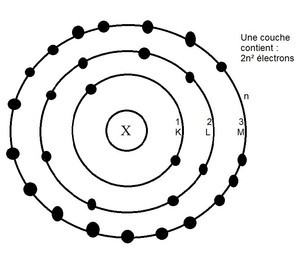
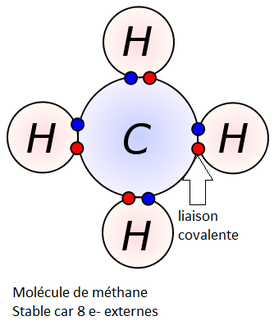
Les atomes sont entourés d’électrons, disposés autour du noyau par couche électronique. Chaque couche peut accueillir un certain nombre d’électrons. Les atomes étant instable, ils existent rarement isolés, à l'exception des gaz nobles. La stabilité chimique des gaz nobles provient de leur structure électronique en duet ou en octet. Les atomes vont donc chercher à atteindre cette stabilité en duet ou en octet sur leur couche externe. Pour ce faire, ils vont prendre des électrons (ou perdre des électrons pour faire un ion) chez leur atome voisin en formant des liaisons covalentes avec celui-ci : c'est une molécule. Chaque liaison formée permet à l'atome de gagner un électron sur sa couche externe et d'atteindre une structure stable.
Donc nous pouvons appliquer ce principe aux colles, un atome du matériau et un atome de la colle vont se partager certains de leurs électrons pour remplir leur dernière couche. La
liaison covalente ainsi crée est particulièrement solide.

Site de TPE sur les colles - 1ère S - 2014/2015
TAVERNIER Nicolas
BOISSIER Sébastien
Lycée Gaston BACHELARD - 10200 Bar-sur-Aube